全微(南京)生物科技有限公司
搜索
产品
联系我们
产品展示
核酸分选试剂
Allmicro MNASelect Kit
适用范围
PCR体系纯化、酶切和连接反应体系纯化。本产品可以结合大于100bp的核酸片段,对于片段长度为10 kb的长片段,也能获得比传统过柱法高得多的得率。
提取操作步骤
1. 将磁珠与试剂提前30 min从4-8℃取出,静置使其温度平衡至室温。
2. 将试剂按照一定体积(具体根据样品情况而定,可参考DNA纯化参考条件)加入样本中,使用移液器吸打约10次或涡旋使溶 液充分混合均匀,随后在室温条件下静置10 min。
3. 把离心管放于磁架上静置5 min,待磁珠完全吸附于离心管侧壁后小心移除上清液。
4. 保持有磁珠的离心管固定于磁力架上,加入200 μL 新配制的80%乙醇,室温孵育2 min,之后弃去溶液。重复该步骤一次。
5. 保持管固定于磁力架上,进一步除去管壁与底部的溶液,之后放置室温3-5 min,使乙醇挥发干。注意:晾干时要避免磁珠过分干燥,如果磁珠出现龟裂,则提示磁珠过分干燥,将可能影响回收率。
6. 将离心管从磁力架上取下,加入适量无核酸酶水,使用移液器 吸打约10次使磁珠完全悬浮于水中,后静置2 min。将离心管放于磁力架上静置3 min,待磁珠完全吸附于离心管侧壁后, 将溶液转移至新的无核酸酶离心管中,-20℃保存。
表1.DNA纯化条件参考
片段分选提取操作步骤
7. 将磁珠与试剂提前30 min从4-8℃取出,静置使其温度平衡至室温。
8. 将试剂按照一定体积(具体根据样品情况而定,可参考分选参 考条件)加入样本中,使用移液器吸打约10次或涡旋使溶液充分混合均匀,随后在室温条件下静置10 min。
9. 把离心管放于磁架上静置5 min,待磁珠完全吸附于离心管侧壁后小心吸取上清液至新的无核酸酶离心管中。
10. 保持有磁珠的离心管固定于磁力架上,加入200 μL 新配制的80%乙醇,室温孵育2 min,之后弃去溶液。重复该步骤一次。
11. 保持管固定于磁力架上,进一步除去管壁与底部的溶液,之后放置室温3-5 min,使乙醇挥发干。注意:晾干时要避免磁珠过分干燥,如果磁珠出现龟裂,则提示磁珠过分干燥,将可能影响回收率。
12. 步骤3上清中加入适量磁珠液混合(第二轮分选),使用移液器吸打约10次或涡旋使溶液充分混合均匀,随后在室温条件下静置10 min。
13. 把离心管放于磁架上静置5 min,待磁珠完全吸附于离心管侧壁后小心吸取上清液至新的无核酸酶离心管中。
14. 保持有磁珠的离心管固定于磁力架上,加入200 μL 新配制的80%乙醇,室温孵育2 min,之后弃去溶液。重复该步骤一次。
15. 保持管固定于磁力架上,进一步除去管壁与底部的溶液,之
16. 后放置室温3-5 min,使乙醇挥发干。
17. 将离心管从磁力架上取下,加入适量无核酸酶水,使用移液 器吸打约10次使磁珠完全悬浮于水中,后静置2 min。将离心管放于磁力架上静置3 min,待磁珠完全吸附于离心管侧壁后,将溶液转移至新的无核酸酶离心管中,-20℃保存。
表2.DNA分选条件参考
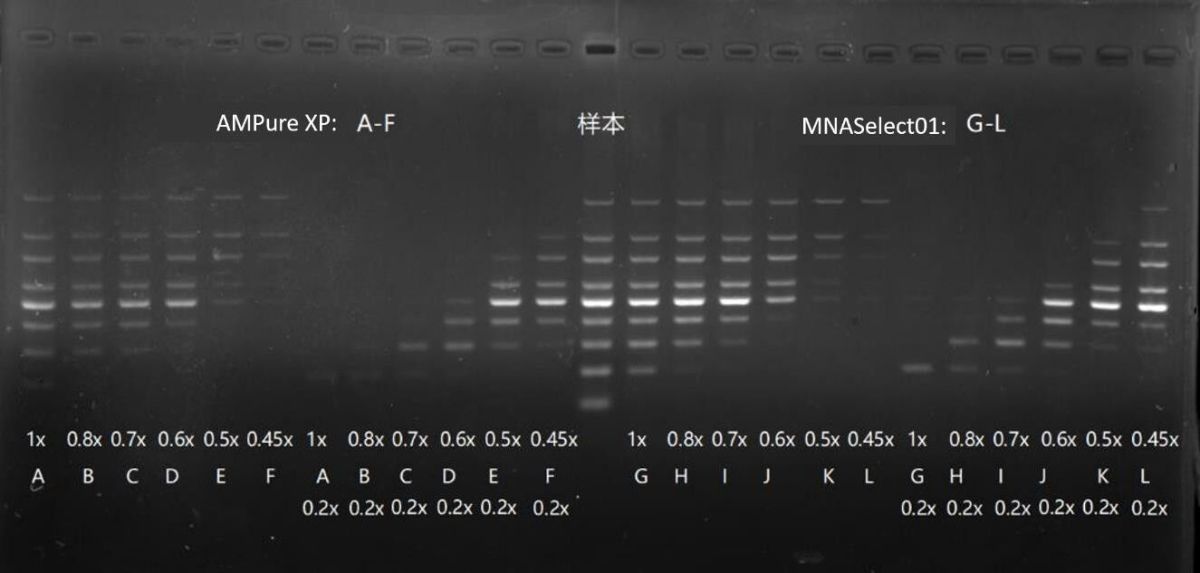
附:片段分选提取实验例 1
鲑鱼精DNA片段样本 1000 ng
注:鲑鱼精DNA样本通过AMPure XP 3x纯化后再使用。
附:片段分选提取实验例 2
在线留言
产品推荐
Please give us a message
Shandong Zhicai Import and Export Co., LTD.
Phone: +86 13953905728
E-mail: hplihui@126.com
Address: Room 1-1307 Lvcheng Lanyue Building A-D, No.22 Wenhua East Road, Lixia District, Jinan City, Shandong Provence, China